Các bài viết chuyên sâu về phần đại cương về kim loại bạn có thể quan tâm:
Tổng hợp các tính chất hóa học của kim loại
Lý thuyết về dãy điện hóa của kim loại
Lý thuyết sự ăn mòn kim loại: Ăn mòn hóa học và ăn mòn điện hóa
Lý thuyết kim loại: điều chế kim loại
I. Vị trí và cấu tạo
1. Vị trí của kim loại trong bảng tuần hoàn
Các nguyên tố hoá học được phân thành kim loại và phi kim. Trong số 110 nguyên tố hoá học đã biết có tới gần 90 nguyên tố là kim loại. Trong bảng tuần hoàn các nguyên tố kim loại có mặt ở :
– Nhóm IA (trừ hiđro) và IIA.
– Nhóm IIIA (trừ Bo) và một phần của các nhóm IVA, VA, VIA.
– Các nhóm B (từ IB đến VIIIB).
– Họ lantan và actini, được xếp riêng thành hai hàng ở cuối bảng.
2. Cấu tạo của nguyên tử kim loại
- Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1, 2 hoặc 3e).
+) Nhóm A dạng: ns1; ns2; ns2np1; ns2np2;… VD: 13Al: 1s22s22p63s23p1
+) Nhóm B dạng: (n-1)dxns2 ( x=1 →10) VD: 26Fe: 1s22s22p63s23p63d64s2
Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim.
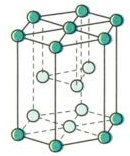
3. Cấu tạo mạng tinh thể kim loại ( trừ thủy ngân ở dạng lỏng):
+ Mạng tinh thể lục phương có độ đặc khít 74%. (Be, Mg, Zn,…)
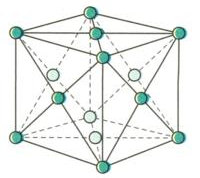
+ Mạng tinh thể lập phương tâm diện có độ đặc khít 74%. (Cu, Ag, Au, Al,…)
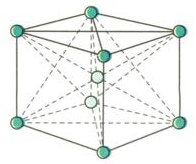
+ Mạng tinh thể lập phương tâm khối có độ đặc khít 68%. (Li, Na, K, V, Mo,…)
Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của electron tự do