I – KHÁI NIỆM
Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh.
- Hệ quả: Kim loại bị oxi hoá thành ion dương
M → Mn+ + ne
II – CÁC DẠNG ĂN MÒN KIM LOẠI
Có 2 dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học
1. Ăn mòn hoá học
VD – Thanh sắt trong nhà máy sản xuất khí Cl2
Fe + Cl2 → FeCl3
⇒ Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
2. Ăn mòn điện hoá học
a. Khái niệm về ăn mòn điện hóa
- Hiện tượng:
– Kim điện kế quay ⇒ chứng tỏ có dòng điện chạy qua.
– Thanh Zn bị mòn dần.
– Bọt khí H2 thoát ra cả ở thanh Cu.
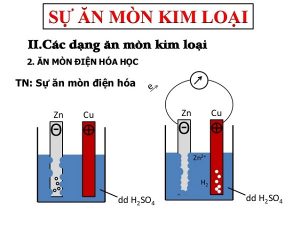
- Giải thích:
– Điện cực âm (anot); Zn bị ăn mòn theo phản ứng: Zn → Zn2+ + 2e
Ion Zn2+ đi vào dung dịch, các electron theo dây dẫn sang điện cực Cu.
– Điện cực dương (catot): ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra.: 2H+ + 2e → H2↑
⇒ Ăn mòn điện hoá là quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
b. Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm
VD: Sự ăn mòn gang trong không khí ẩm.
– Trong không khí ẩm, trên bề mặt của gang luôn có một lớp nước rất mỏng đã hoà tan O2 và khí CO2 , tạo thành dung dịch chất điện li.
– Gang có thành phần chính là Fe và C cùng tiếp xúc với dung dịch đó tạo nên vô số các pin nhỏ mà sắt là anot và cacbon là catot.
Tại anot: Fe → Fe2+ + 2e
Các electron được giải phóng chuyển dịch đến catot.
Tại catot: O2 + 2H2O + 4e → 4OH–
Ion Fe2+ tan vào dung dịch chất điện li có hoà tan khí O2.Tại đây, ion Fe2+ tiếp tục bị oxi hoá, dưới tác dụng của ion OH− tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O.
c. Điều kiện xảy ra sự ăm mòn điện hoá học
- Các điện cực phải khác nhau về bản chất.
Cặp KL – KL; KL – PK; KL – Hợp chất hoá học
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn.
- Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
III, Các phương pháp chống ăn mòn kim loại
1, Phương pháp bảo vệ bề mặt: sơn; mạ kim loại
2, Phương pháp điện hóa
3, Sản xuất vật liệu không bị ăn mòn: hợp kim không bị ăn mòn
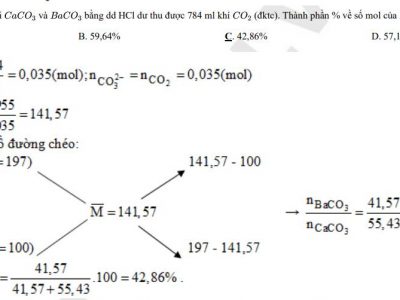
Bài tập pin điện hóa có lời giải
Bài 1: Tính thế điện cực chuẩn E0 của những cặp oxi hóa khử sau:
a. E0 (Cr3+/Cr), biết suất điện động chuẩn của pin điện hóa Cr -Ni là +0,51V và E0 (Ni2+/Ni) = -0,23V.
b. E0 (Mn2+/Mn), biết suất điện động chuẩn của pin điện hóa Cd -Mn là +0,79V và E0(Cd2+/Cd) = -0,40V.
Hướng dẫn
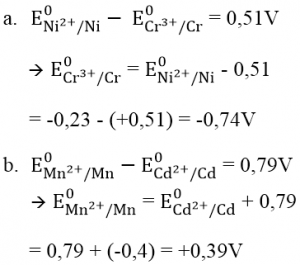
Xem thêm: