Quy tắc đường chéo – Phương pháp đường chéo.
- Phương pháp đường chéo là phương pháp thường được áp dụng cho các bài toán hỗn hợp chứa 2 thành phần mà yêu cầu của bài toán là xác định tỉ lệ giữa 2 thành phần đó.
- Đây là phương pháp có nhiều ưu điểm, giúp tăng tốc độ tính toán, và là 1 công cụ bổ trợ rất đắc lực cho phương pháp trung bình.
- Phương pháp đường chéo có thể áp dụng tốt cho nhiều trường hợp, nhiều dạng bài tập, đặc biệt là dạng bài pha chế dung dịch và tính thành phần hỗn hợp.
Thường sử dụng kết hợp giữa đường chéo với phương pháp trung bình và phương pháp bảo toàn nguyên tố. Với hỗn hợp phức tạp có thể sử dụng kết hợp nhiều đường chéo.
Trong đa số trường hợp không cần thiết phải viết sơ đồ dường chéo nhằm rút ngắn thời gian làm bài. - Nhược điểm của phương pháp này là không áp dụng được cho những bài toán trong đó có xảy ra phản ứng giữa các chất tan với nhau, không áp dụng được với trường hợp tính toán pH
Các bước giải bài toán bằng phương pháp đường chéo
- Xác định trị số cần tìm từ đề bài
- Chuyển các số liệu sang dạng đại lượng % khối lượng
- Xây dựng đường chéo → Kết quả bài toán.
Các dạng bài tập về phương pháp đường chéo
- Dạng 1: Tính toán hàm lượng các đồng vị
+) Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số khối nên cùng thuộc một nguyên tố hóa học và có cùng vị trí trong bảng tuần hoàn các nguyên tố hóa học.
+) Khác với số khối của đồng vị, khối lượng nguyên tử trung bình là giá trị trung bình các số khối của đồng vị tạo nên nguyên tố đó. Trong trường hợp nguyên tố được tạo nên bởi 2 đồng vị chủ yếu, ta có thể dễ dàng tính được hàm lượng chất mỗi đồng vị bằng phương pháp đường chéo
Ví dụ:

- Dạng 2: Tính tỷ lệ thành phần của hỗn hợp khí qua tỷ khối
Ví dụ:
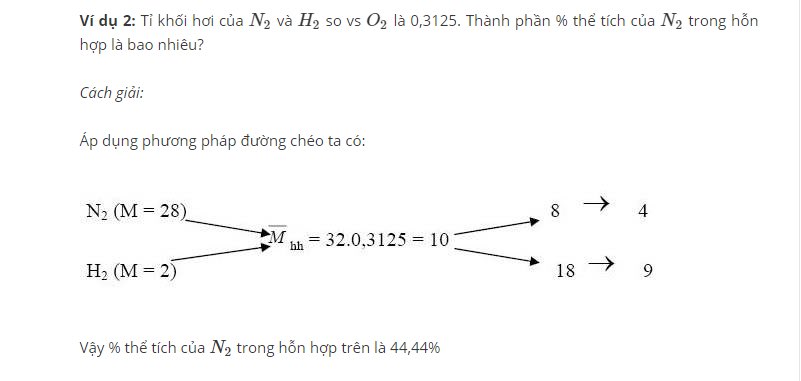
Dạng 3: Tính tỷ lệ các chất trong hỗn hợp 2 chất vô cơ
Ví dụ:
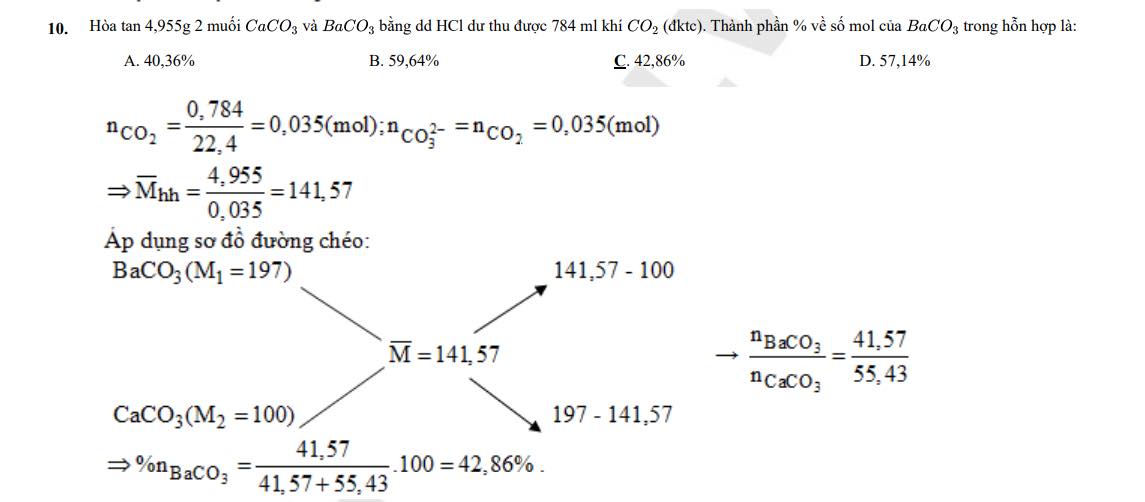
Dạng 4: Tính tỷ lệ các chất trong hỗn hợp hai chất hữu cơ

Dạng 5: Tính toán trong pha chế các dung dịch có cùng chất tan
- Dung dịch 1: Có khối lượng m1, thể tích V1, nồng độ C1, khối lượng riêng d1
- Dung dịch 2: Có khối lượng m2, thể tích V2, nồng độ C2 (C2>C1), khối lượng riêng d2
- Dung dịch thu được: có khối lượng m=m1+m2, thể tích V=V1+V2 và khối lượng riêng d.
Một số bài tập tự vận dụng
Bài 1:Hoà tan hoàn toàn 5,2 gam hai kim loại kiềm ở hai chu kì kế tiếp nhau vào nước thu được 2,24 lít H2 (đktc) bay ra. Hai kim loại đó là:
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
Bài 2:Hỗn hợp A gồm 2 kim loại X,Y có hóa trị không đổi và không có kim loại nào hóa trị I. Lấy 7,68g hỗn hợp A chia thành 2 phần bằng nhau:
– Phần 1: nung trong khí O2 dư để oxi hóa hoàn toàn, thu được 6g hỗn hợp rắn B gồm 2 oxit
– Phần 2: hòa tan hoàn toàn trong dd chứa HCl và H2SO4 loãng, thu được V lit khí H2 (đktc) và ddC. Tính V.
A. 2,352 lit B. 4,704 lit C. 3,024 lit D. 1,176 lit
Bài 3: Cho 14 gam hỗn hợp hai anken là đồng đẳng liên tiếp đi qua dung dịch nước Br2 thấy làm mất màu vừa đủ dung dịch chứa 64 gam Br2 . Công thức phân tử của các anken là
A. C2H4; C3H6 B. C3H6; C4H8 C. C4H8; C5H10 D. C5H10; C6H12
Bài 4: Cho axit oxalic HOOC-COOH tác dụng với hỗn hợp hai ancol no, đơn chức, đồng đẳng liên tiếp thu được 5,28 gam hỗn hợp 3 este trung tính. Thủyphân lượng este trên bằng dung dịch NaOH thu được 5,36 gam muối. Hai rượu có công thức:
A. CH3OH; C2H5OH B. C2H5OH; C3H7OH C. C3H7OH; C4H9OH D.C4H9OH; C5H11OH
Xem thêm:
Phương trình ion rút gọn – Dạng bài tập thường gặp trong đề thi
Định luật bảo toàn điện tích – Dạng bài tập thường gặp trong đề thi








