1, Cơ sở và đặc điểm phương pháp tăng giảm khối lượng
- Là phương pháp giải toán dựa vào quan hệ về số lượng
- Dấu hiệu: khi đề bài cho ít nhất 1 số liệu ở dạng khối lượng mà không đổi thành số mol được hoặc không biểu diễ thành phương trình được
- Tăng giảm khối lượng
+) Gắn sự thay đổi về khối lượng( tăng/ giảm) với số mol 1 chất trong phản ứng
+) Thường gặp trong các phản ứng có yếu tố thay thế/ trao đổi
VD: trong phản ứng: Fe + CuSO4 → Cu + FeSO4
thì cứ 1mol Fe phản ứng( 1 mol Cu↓) → mr tăng = 64-56 = 8g
trong phản ứng: MCO3 + 2HCl → MCl2 + CO2↑ + H2O
thì cứ 1mol CO2↑ → mm tăng = 35,5.2 – 60 = 11g
Một số ví dụ minh họa

Bài tập tự vận dụng
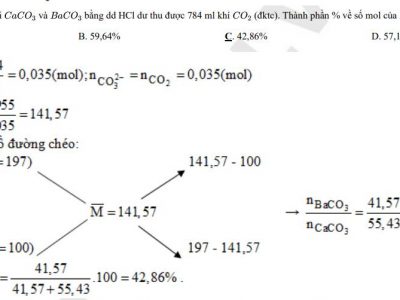
Bài 1:Hòa tan 5,94 gam hỗn hợp hai muối clorua của hai kim loại A, B (đều có hóa trị II) vào nước được dung dịch X. Để làm kết tủa hết ion Cl– có trong dung dịch X người ta cho dung dịch X tác dụng với dung dịch AgNO3 thu được 17,22 gam kết tủA. Lọc bỏ kết tủa, thu được dung dịch Y. Cô cạn Y được m gam hỗn hợp muối khan. Giá trị của m là: A. 6,36 gam B. 63,6 gam C. 9,12 gam D. 91,2 gam
Bài 2: Cho một luồng CO đi qua ống sứ đựng 0,04 mol hỗn hợp A gồm FeO và Fe2O3 nung nóng. Sau khi kết thúc thí nghiệm thu được B gồm 4 chất nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư thì thu được 9,062 gam kết tủA. Phần trăm khối lượng Fe2O3 trong hỗn hợp A là:
A. 86,96% B. 16,04% C. 28,99% D. 71,01%
Bài 3:Cho 1,26 gam một kim loại tác dụng với dung dịch H2SO4 loãng tạo ra 3,42 gam muối sunfat. Kim loại đó là:
A. Mg B. Fe C. Ca D. Al
Bài 4: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là:
A. 0,8 gam B. 8,3 gam C. 2,0 gam D. 4,0 gam
Xem thêm:
Định luật bảo toàn khối lượng – Dạng bài tập thường gặp trong đề thi
Phương pháp bảo toàn nguyên tố – Dạng bài tập thường gặp trong đề thi