1, Cơ sở và đặc điểm định luật bảo toàn khối lượng
- Là phương pháp giải toán dựa vào quan hệ về số lượng
- Dấu hiệu: khi đề bài cho ít nhất 1 số liệu ở dạng khối lượng mà không đổi thành số mol được hoặc không biểu diễ thành phương trình được
- Bảo toàn khối lượng dựa trên 2 quan hệ:
+) BTKL cho phản ứng: ∑mtrcpu = ∑msaupu
VD: Nếu pư là A+ B → C + D
thì mA + mB = mC + mD
+) BTKL cho chất/ hh: mchất/hh = ∑mcác tp
VD: mhh oxit = mhh KL + mO / mhh muối = mhh KL + mgốc axit
mCxHyOzNt = mC + mH + mO + mN
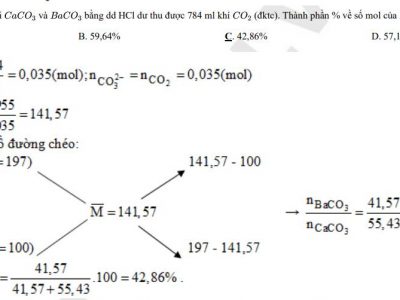
Một số ví dụ minh họa

Bài tập tự vận dụng
Bài 1:Cho 50 gam dung dịch BaCl2 20,8% vào 100 gam dung dịch Na2CO3 , lọc bỏ kết tủa được dung dịch B, thêm 50 gam dung dịch H2SO4 9,8% vào dung dịch B thấy thoát ra 0,448 lít khí (đktc) (các phản ứng xảy ra hoàn toàn). Nồng độ % của dung dịch Na2CO3 và khối lượng dung dịch thu được sau cùng là:
A. 8,15% và 198,27 gam. B. 7,42% và 189,27 gam.
C. 6,65% và 212,5 gam. D. 7,42% và 286,72 gam
Bài 2: Cho a gam hỗn hợp hai muối Na2CO3 và NaHSO3 có số mol bằng nhau tác dụng với dung dịch H2SO4 loãng, dư. Khí sinh ra được dẫn vào dung dịch Ba(OH)2 dư thu được 41,4 gam kết tủa. Giá trị của a là:
A. 20 B. 21 C. 22 D. 23
Bài 3: Cho luồng khí CO đi qua 30 gam hỗn hợp X gồm MgO, CuO, Fe3O4 nung nóng, sau một thời gian thu được 26 gam hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho Z lội chậm qua bình đựng nước vôi trong dư thu được m gam kết tủa. Giá trị của m là:
A. 15 B. 25 C. 20 D. 30
Bài 4: Dẫn luồng khí CO dư đi qua 21,8 gam hỗn hợp X gồm Al2O3 và FexOy , nung nóng, sau khi phản ứng kết thúc, thu được hỗn hợp Y gồm Al2O3 , Fe. Để hòa tan hoàn toàn hỗn hợp Y cần 450 ml dung dịch HCl 2M. Kết thúc phản ứng thấy có 3,36 lít khí (đktc) thoát ra. Côngthức phân tử của sắt là
A. Fe2O3 B. FeO hoặc Fe2O3 C. Fe3O4 D.FeO
Xem thêm:
Quy tắc đường chéo – Phương pháp trung bình: Các dạng bài tập hay
Định luật bảo toàn điện tích – Dạng bài tập thường gặp trong đề thi