Nhôm và hợp chất của nhôm: Tính chất vật lí, tính chất hóa học của nhôm
A- Nhôm
I, Cấu tạo nguyên tử- Vị trí trong bảng tuần hoàn
- Al ở ô số 13, thuộc nhóm IIIA, chu kì 3 của bảng tuần hoàn
- Cấu hình electron nguyên tử: ⌊Ne⌋ 3s23p1
II, Tính chất của nhôm
1, Tính chất vật lí
- Nhôm là kim loại màu trắng bạc, nóng chảy ở 660oC, khá mềm, dễ kéo sợi, dễ dát mỏng.
- Nhôm là kim loại nhẹ, dẫn điện tốt, dẫn nhiệt tốt.
2, Tính chất hóa học
Tính khử mạnh: Al0 → Al3+ + 3e
a, Phản ứng phi kim:
2Al0 + 3Cl0(r) –to→ 2AlCl3
2Al + 3O2 –to→ 2Al2O3
b, Phản ứng với axit
- Với axit HCl, H2SO4…→ H2↑
VD 2Al + 6HCl → 2AlCl3 + 3H2↑ ⇔ 2Al + 6H+ → 2Al3+ + 3H2↑
- Với axit HNO3, H2SO4đ, to
VD: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
- Al, Cr, Fe bị thụ động trong dung dịch H2SO4(đ) ,nguội; HNO3(đ) ,nguội
c, Phản ứng với H2O
Ở điều kiện thường Al( tinh khiết) khử H2O tạo H2↑
2Al + 6H-OH → 2Al(OH)3↓ + 3H2↑
d, Phản ứng với dung dịch kiềm mạnh(NaOH, Ba(OH)2….)
- Phản ứng của Al (tinh khiết)
B1: 2Al + 6HOH → 2Al(OH)3↓ + 3H2↑
B2: 2Al(OH)3↓ + 2OH– → 2AlO2– + 4H2O
⇒ 2Al + 2H2O + 2OH– → 2AlO2– + 3H2↑
- Phản ứng vật bằng nhôm
+) Al2O3 + 2OH– → 2AlO2– + H2O
+) Al(OH)3 + OH– → 2AlO2– + H2O
e, Phản ứng với oxit kim loại: phản ứng nhiệt nhôm
VD: 8Al + 3Fe3O4 –to→ 4Al2O3 + 9Fe
2Al + Cr2O3 –to→ Al2O3 + 3Cr
III, Ứng dụng- sản xuất nhôm
1, Ứng dụng
- Nhôm và hợp kim của nhôm có ưu điểm nhẹ bền đối với không khí và nước nên được dùng làm vật liệu chế tạo máy bay, ô tô, tên lửa,…
- Nhôm và hợp kim của nhôm có màu trắng bạc, đẹp nên được sử dụng để xây dựng nhà cửa
- Nhôm nhẹ dẫn điện tốt nên được dùng thay cho đồng.
- Bột nhôm trộn với bột sắt oxit( hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng hàn đường ray.
2, Trạng thái tự nhiên
- Đất sét: Al2O3.2SiO2.2H2O
- Cao lanh: K2O.Al2O3.6SiO2
- Boxit: Al2O3.2H2O
- Criolit: 3NaF.AlF3
3, Sản xuất nhôm
- Nguyên tắc: 2Al2O3 –đpnc→ 4Al + 3O2
- Nguyên liệu: nguyên liệu chính quặng boxit: Al2O3.2H2O; Criolit
- Quá trình sản xuất: – B1 làm sạch quặng: dùng dung dịch NaOH, CO2
Quặng Boxit + dd NaOH→ AlO2– + CO2 + H2O → Al(OH)3↓
– B2: quá trình điện phân: điện phân hỗn hợp Al2O3 và Na3AlF6 với than chì, Anot bị oxi hóa tạo CO2, CO,..
B- Một số hợp chất quan trọng của nhôm
I, Nhôm oxit (Al2O3)
1, Tính chất
a, Tính chất vật lí: chất rắn màu trắng, không tan trong nước, rất bền nhiệt, nóng chảy trên 2050oC
b, Tính chất hóa học: Là oxit lưỡng tính
- Phản ứng với dung dịch axit (H+):
Al2O3 + 6HCl → 2AlCl3 + 3H2O ⇔ Al2O3 + 6H+ → 2Al3+ + 3H2O
- Phản ứng với dung dịch bazo kiềm mạnh (NaOH, Ca(OH)2,…)
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O ⇔ Al2O3 + 2OH– → 2AlO2– + H2O
2, Ứng dụng: Trọng tự nhiên nhôm oxit tồn tại:
- Dạng ngậm nước (Al2O3.2H2O) chủ yếu quặng Boxit ứng dụng để sản xuất nhôm
- Dạng than tồn tại cấu trúc đá quý:
+) Corindon dạng tinh thể trong suốt, không màu, rất rắn dùng để làm đá mài, giấy nhám
+) Hồng ngọc thế Al2O3 một số Al3+ thay bằng Cr3+. ứng dụng làm đá quý, đồ trang sức
+) Saphia tinh thể Al2O3 lần tạp chất Fe2+, Fe3+ và Ti4+
+) Bột Al2O3 chất xúc tác trong tổng hợp hữu cơ.
II, Nhôm hidroxit (Al(OH)3)
1, Tính chất
a, Tính chất vật lí
Al(OH)3 là chất rắn, màu trắng, kết tủa ở dạng keo.
b, Tính chất hóa học: là hidroxit lưỡng tính
- Với dung dịch axit
Al(OH)3↓ + 3H+→ Al3+ + 3H2O ⇔ Al(OH)3 + 3HNO3 → Al(NO3)3 + H2O
- Với dung dịch bazo kiềm mạnh
Al(OH)3↓ + OH– → AlO2– + 2H2O ⇔ Al(OH)3 + KOH → KAlO2 + 2H2O
c, Điều chế: dd NH3 + dd AlCl3
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl ⇔ Al3+ + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4+
III, Muối được tạo bởi cation nhôm (Al3+): AlCl3, Al2(SO4)3, Al(NO3)3,…
1, Tính chất
a, Tính chất vật lí
b, Tính chất hóa học
- dd Al3+ + dd NH3, CH3NH2,..( bazo kiềm yếu) tạo ↓
- dd Al3+ + dd OH– ( bazo kiềm mạnh) phản ứng có thể
+) Al3+ + 3OH– → Al(OH)3↓
+) Al(OH)3↓ + 3OH– → AlO2– + 2H2O
⇒ Al3+ + OH–(dư) → AlO2– + 2H2O
- 4Al(NO3)3 –t0→ 2Al2O3 + 12NO2 + 3O2
2, Ứng dụng của muối sunfat
Dạng muối kép, chủ yếu phèn chua: K2SO4.Al2(SO4)3.24H2O ⇔ KAl(SO4)2.12H2O
Ứng dụng trong ngành thuộc da, công nghiệp giấy, chất làm trong nước
Mở rộng: thay K+ bằng Li+, Na+, NH4+ ta được muối kép khác tên là phèn nhôm
IV- Muối aluminat (AlO2–)
a, Tính chất hóa học: phản ứng trao đổi ion, AlO2– + dd axit
- Phản ứng với CO2:
AlO2– + H2O + CO2 → Al(OH)3↓ + HCO3– ⇔ NaAlO2 + H2O + CO2 → Al(OH)3↓+ NaHCO3
- Phản ứng với dd H+ ( HCl, H2SO4, HNO3…)
B1: AlO2– + H+ + H2O → Al(OH)3↓
B2: Al(OH)3 + 3H+ → Al3+ + 3H2O
⇒ Phương trình tổng hợp: AlO2– + 4H+ (dư) → Al3+ + 2H2O
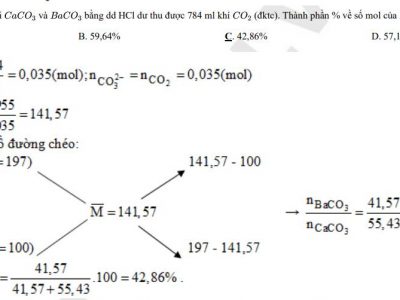
Bài tập lý thuyết áp dụng
Bài 1. Kim loại nào sau đây vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH?
A. Fe. B. Al. C. Cu. D. Ag.
Bài 2. Phát biểu nào sau đây là đúng?
A. Nhôm là kim loại lưỡng tính.
B. Nhôm hiđroxit chỉ thể hiện tính bazơ.
C. Nhôm oxit là oxit trung tính.
D. Nhôm hiđroxit là hiđroxit lưỡng tính.
Bài 3. Nước ta có nguồn quặng boxit trữ lượng lớn ở Tây Nguyên đang được khai thác để sản xuất nhôm. Thành phần hóa học chủ yếu của quặng boxit là
A. Al2O3.2SiO2.2H2O. B. 3NaF.AlF3. C. K2O.Al2O3.6SiO2 D. Al2O3.2H2O
Kiến thức liên quan:
Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ