A, Kim loại kiềm thổ
I, Vị trí trong bảng tuần hoàn hóa học, cấu hình electron nguyên tử
1, Ví trí trong bảng tuần hoàn hóa học: Thuộc nhóm IIA
Gồm: Be; Mg; Ca; Sr; Ba
2, Cấu hình electron nguyên tử: Lớp ngoài cùng dạng ns2 (n≥2)
II, Trạng thái tồn tại, tính chất vật lí
1, Dạng đơn chất:
- Be, Mg kiểu mạng tinh thể lục phương
- Ca, Sr kiểu mạng tinh thể lập phương tâm diện
- Ba kiểu mạng tinh thể lập phương tâm khối
2, Tính chất vật lí
- Các kim loại kiềm thổ có màu trắng bạc, có thể dát mỏng.
- Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp
- Khối lượng riêng tương đối nhỏ, nhẹ hơn nhôm( trừ Ba)
- Độ cứng cao hơn kim loại kiềm nhưng vẫn tương đối mềm
III, Tính chất hóa học
Tính khử mạnh: M→ M2+ + 2e
1, Tác dụng với phi kim
VD: Ba + Cl2 —to→ BaCl2
2Mg + O2 —to→ 2MgO
2, Tác dụng với axit
a, Với dung dịch HCl, H2SO4 ( 2H+/ H2)
VD: Mg + 2HCl → MgCl2 + H2↑ ⇔ Mg + H+ → Mg2+ + H2
b, Với HNO3, H2SO4đ, to
VD: 5Ca + 12HNO3 → 5Ca(NO3)2 + N2 + 6H2O ⇔ 5Ca + 12H+ + 2NO3– → 5Ca2+ + N2 + H2O
4Mg + 5H2SO4(đ) —to→ 4MgSO4 + H2S + 4H2O
3, Tác dụng với H2O
- Ca, Sr, Ba,…. phản ứng ở điều kiện thường
VD: Ba + 2H-OH → Ba(OH)2 + H2↑
- Mg phản ứng chậm
VD: Mg + H2O –to→ MgO + H2↑
- Be không khử được nước
IV, Điều chế
1, Trạng thái tự nhiên: CaCO3 ( đá vôi, canxi); MgCO3; CaCO3.MgCO3; Ca3(PO4)2; Ca3(PO4)2.3CaF2
2, Điều chế: Cation kim loại kiềm thổ rất khó bị khử
Phương pháp điện phân nóng chảy
VD: MgCl2 —đpnc→ Mg + Cl2
B, Một số hợp chất quan trọng của Canxi
1, Canxin hidroxit (Ca(OH)2)
- Ca(OH)2 còn gọi là vôi tôi, chất rắn màu trắng, ít tan trong nước
Dung dịch loãng của Ca(OH)2: nước vôi trong
- Tính chất hóa học
+) Dễ hấp thụ CO2 : CO2 + Ca(OH)2 → CaCO3↓ + H2O
⇒ Ca(OH)2 là bazo mạnh, lại rẻ tiền nên được sử dụng rộng rãi trong nhiều ngành công nghiệp: sản xuất amoniac(NH3), vật liệu xây dựng,…
2, Canxi cacbonat
- CaCO3 là chất rắn màu trắng, không tan trong nước, bị phân hủy ở nhiệt độ khoảng 1000oC
CaCO3 –to→ CaO + O2
- Phản ứng với oxit (≥ H2O + CO2)
CaCO3↓ + H2O + CO2 ⇔ Ca(HCO3)2
⇒ Phản ứng trên giải thích sự tạo thành thạch nhũ trong các hang đá vôi, cặn trong ấm nước,…
- Đá vôi dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, thủy tinh,….
3, Canxi sunfat (CaSO4)
a, Trong tự nhiên, CaSO4 tồn tại dưới dạng muối ngậm nước CaSO4.2H2O gọi là thạch cao sống
- Thạc cao sống: CaSO4.2H2O –160O→ CaSO4.H2O + H2O↑
- Thạc cao nung: CaSO4.H2O –350o→ CaSO4 + H2O
- Thạch cao khan: CaSO4
b, Ứng dụng: sản xuất xi măng, thạch cao nung để đắp tượng, bó bột,..
Bài tập áp dụng lý thuyết
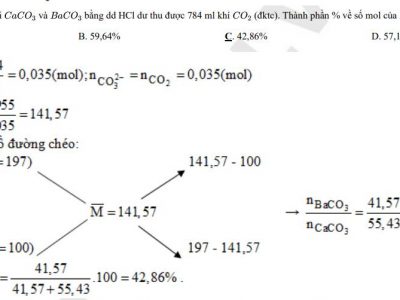
Bài 1. Ở nhiệt độ thường, dung dịch Ba(HCO3)2 không tác dụng với dung dịch nào sau đây?
A. Ba(OH)2 B. HNO3 C. NaCl. D. Na2CO3
Bài 2. Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2, vừa thu được kết tủa, vừa có khí bay ra?
A. NaOH. B. HCl. C. Ca(OH)2 D. H2SO4
Bài 3. Tiến hành các thí nghiệm pha trộn từng cặp dung dịch sau:
(a) NaOH và nước có tính cứng tạm thời. (b) Ba(OH)2 và Na2SO4
(c) Nước vôi trong và NaHCO3 (d) Na2CO3 và nước có tính cứng vĩnh cửu.
Số thí nghiệm tạo thành kết tủa khi kết thúc phản ứng là
A. 4.
B. 3.
C. 2.
D. 1
Kiến thức liên quan:
Nhôm và hợp chất của nhôm: Tính chất vật lí, tính chất hóa học của nhôm