Lý thuyết dãy điện hóa của kim loại
I, Cặp oxi hóa-khử của kim loại
1, Khái niệm
- Nguyên tử kim loại dễ nhường electron để trở thành ion kim loại, ngược lại ion kim loại có thể nhận electron để trở thành ion kim loại
VD1: Fe0 + CuSO4 → FeSO4 + Cu0↓ ⇒ Cu2+ + 2e → Cu0 (1)
VD2: Cu0 + 2AgNO3 → Cu(NO3)2 + 2Ag↓ ⇒ Cu0 → Cu2+ + 2e (2)
Từ (1),(2) ⇒ Cu2+ + 2e ⇔ Cu0
chất oxi hóa chất khử
- Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
VD: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
2. So sánh các cặp oxh-khử
VD: So sánh tính chất của hai cặp oxi hoá – khử Cu2+/Cu và Ag+/Ag.
Cu + 2Ag+→ Cu2+ + 2Ag
Kết luận: Tính khử: Cu > Ag
Tính oxi hoá: Ag+ > Cu2+
II, Dãy điện hóa của kim loại

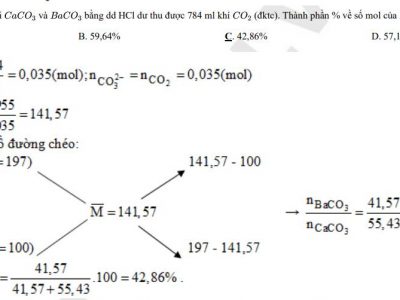
- Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc α: Phản ứng giữa hai cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn, sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
- VD: Phản ứng giữa hai cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hoá Fe tạo ra ion Fe2+ và Cu ⇒ Fe + Cu2+ → Fe2+ + Cu
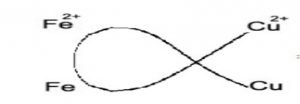
- Tổng quát: Giả sử có 2 cặp oxi hoá – khử Xx+/X và Yy+/Y (cặp Xx+/X đứng trước cặp Yy+/Y)
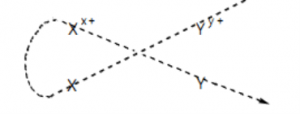
- Phương trình phản ứng: Yy+ + X → Xx+ + Y
Xem thêm:
Lý thuyết sự ăn mòn kim loại: Ăn mòn hóa học và ăn mòn điện hóa