1, Cơ sở và đặc điểm phương pháp bảo toàn nguyên tố
Là phương pháp giải toán dựa vào quan hệ về số mol: nng tố = hệ số . nchất
→ Dấu hiệu: +) Khi đề bài cho các số liệu đều dưới dạng số mol/ thể tích
→ dùng số mol/ thể tích đó làm hệ số các chất trong phương trình phản ứng rồi bảo toàn nguyên tố
+) Nếu đầu bài cho số liệu về O2 trong phản ứng đốt cháy → bảo toàn nguyên tố Oxi
2, Ví dụ minh họa
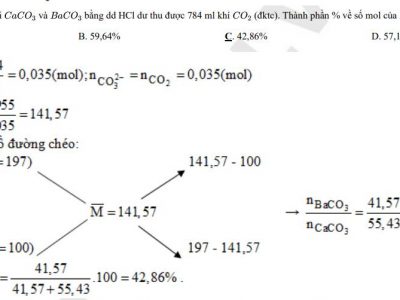
Câu 1: Hòa tan hỗn hợp X gồm 0,2 mol Fe và 0,1 mol Fe2O3 vào dung dịch HCl dư được dung dịch D. Cho dung dịch D tác dụng với NaOH dư thu được kết tủa. Lọc kết tủa, rửa sạch đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn Y. Giá trị của m là:
A. 16,0 gam B. 30,4 gam C. 32,0 gam D. 48,0 gam
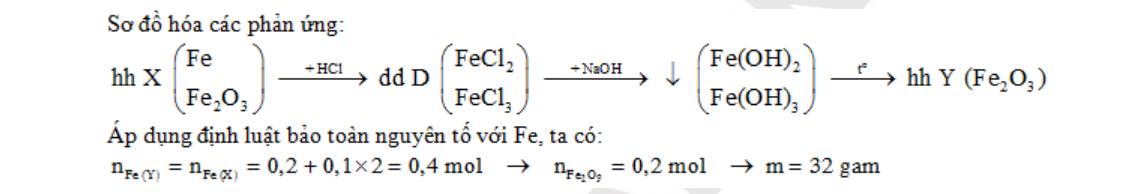
Câu 2:Hoà tan hoàn toàn a gam hỗn hợp X gồm Fe và Fe2O3 trong dung dịch HCl thu được 2,24 lít khí H2 ở đktc và dung dịch B. Cho dung dịch B tác dụng dung dịch NaOH dư, lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi thu được 24 gam chất rắn. Giá trị của a là:
A. 3,6 gam B. 17,6 gam C. 21,6 gam D. 29,6 gam
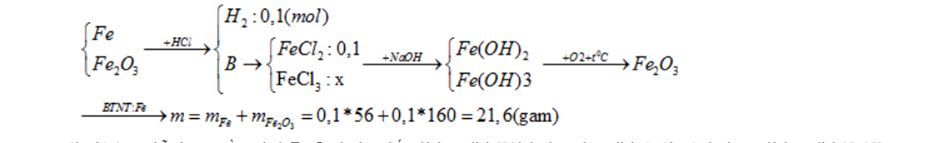
Câu 3: Cho 21,4 gam hỗn hợp A gồm Al và Fe2O3 tác dụng hết với dung dịch HCl dư được dung dịch C. Cho C tác dụng với dung dịch NaOHdư được kết tủa D. Nung D trong không khí đến khối lượng không đổi thu được 16 gam chất rắn. Khối lượng Al và Fe2O3 trong hỗn hợp A lần lượt là:
A. 10,8 gam và 8 gam B. 5,4 gam và 16 gam C. 16 gam và 5,4 gam D. 13,4 gam và 8 gam
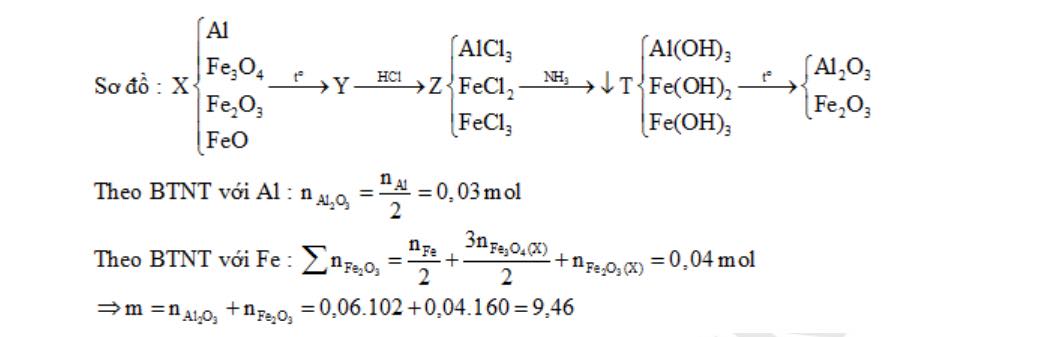
Câu 4:Đun nóng hỗn hợp bột X gồm 0,06 mol Al, 0,01 mol Fe3O4 , 0,015 mol Fe2O3 và 0,02 mol FeO một thời gian. Hỗn hợp Y thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch HCl dư, thu được dung dịch Z. Thêm NH3 vào Z cho đến dư, lọc kết tủa T, đem nungngoài không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
A. 6,16 gam B. 6,40 gam C. 7,78 gam D. 9,46 gam
Câu 5: Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ), thu được dung dịch X (chỉ chứa hai muối sunfat) và khí duy nhất NO. Giá trị của a là:
A. 0,06 mol B. 0,04 mol C. 0,12 mol D. 0,075 mol
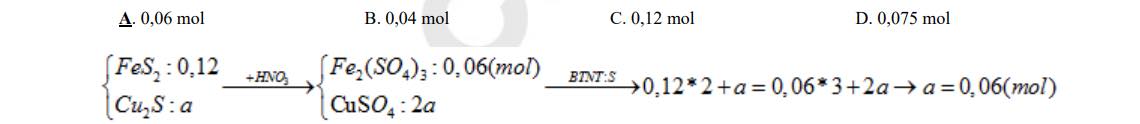
Bài tập tự vận dụng
Bài 1: Hòa tan hoàn toàn hỗn hợp gồm 0,27 gam bột nhôm và 2,04 gam bột Al2O3 trong dung dịch NaOH dư thu được dung dịch X. Cho CO2 dư tác dụng với dung dịch X thu được kết tủa Y, nung Y ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn Z. Biết hiệu suất các phản ứng đều đạt 100%. Khối lượng của Z là:
A. 2,04 gam B. 2,31 gam C. 3,06 gam D. 2,55 gam
Bài 2: Hấp thụ hoàn toàn 2,688 lít khí CO2 (ở đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là:
A. 0,048M B. 0,032M C. 0,04M D. 0,06M
Bài 3: Cho 224 ml khí CO2 (đktc) hấp thụ hết trong 100 ml dung dịch KOH 0,2M. Khối lượng của muối tạo thành là:
A. 1,38 gam B. 2 gam C. 1 gam D. 1,67 gam
Bài 4: Cho hỗn hợp gồm 0,3 mol Fe, 0,15 mol Fe2O3 và 0,1 mol Fe3O4 tác dụng hết với dung dịch H2SO4 loãng thu được dung dịch A. Cho dung dịch A tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn C. Tính m
A. 70. B. 72. C. 65. D. 75.
Bài 5: Hòa tan hết 19,6 gam hỗn hợp X gồm Fe3O4 và CuO bằng một lượng vừa đủ dung dịch HCl 1M, thu được dung dịch Y. Cho Y tác dụng với lượng dư dung dịch H2S , kết thúc các phản ứng thu được 11,2 gam kết tủa. Thể tích dung dịch HCl 1M đã dùng là:
A. 300 ml. B. 600 ml. C. 400 ml. D. 615 ml.
Xem thêm:
Quy tắc đường chéo – Phương pháp trung bình: Các dạng bài tập hay
Định luật bảo toàn điện tích – Dạng bài tập thường gặp trong đề thi