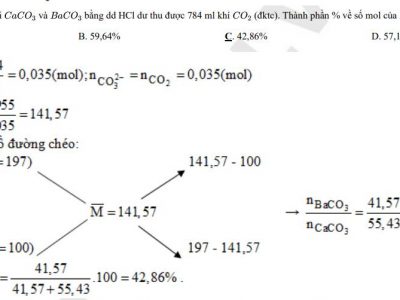
Các kiến thức liên quan trong chương Amin, Amino Axit Và Protein bạn có thể quan tâm:
Các dạng bài tập Amin trọng điểm hay có trong kì thi
Lý thuyết về Peptit và Protein hay gặp trong đề thi THPT
Lý thuyết Anilin C6H7N: tính chất hóa học, tính chất vật lí, điều chế, ứng dụng
Lý thuyết amino axit: cách gọi tên, tính chất hóa học, tính chất vật lí, điều chế, ứng dụng
Lý thuyết Amin
Khi ta thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được Amin.
Bậc của Amin chính là số nguyên tử H được thay thế
Công thức tổng quát của Amin
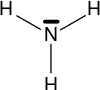
Amoniac
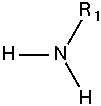
Amin bậc 1
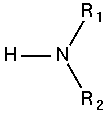
Amin bậc 2
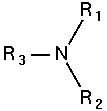
Amin bậc 3
Còn nếu nhóm amin liên kết với vòng benzen, chúng ta có hợp chất amin thơm. Hợp chất đơn giản nhất của dãy amin thơm là anilin.
I- Tính chất vật lý
- Các amin thấp như các metylamin, đimetylamin, trimetylamin và etylamin là những chất khí, có mùi gần giống amoniac, tan nhiều trong nước.
- Các amin bậc cao hơn là những chất lỏng, có một số là chất rắn. Nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối
- Các amin thơm là chất lỏng hoặc rắn, dễ bị oxy hóa. Từ không màu chuyển thành màu đen khi để trong không khí do bị oxy hóa
- Các amin đều độc
II- Tính chất hóa học
a, Tính bazo
- Nhúng quỳ tím vào dung dịch metylamin hoặc propylamin, quỳ tím=> chuyển xanh. Do khi tan trong nước sinh ra ion OH–. Ví dụ:
CH3NH2 + H2O → ⌈CH3NH3⌉+ +OH–
- Nhờ có tính bazơ, amin tác dụng với axit sinh ra muối amoni. Ví dụ:CH3NH2 + H2SO4 → (CH3NH3)2SO4 (Metylamoni sulfat)
- Các amin có tính bazơ mạnh hơn sẽ đẩy được các amin có tính bazơ yếu hơn hoặc các bazơ yếu ra khỏi muối của nó. Ví dụ:
CuCl2 + 2CH3NH2 + 2H2O → 2[CH3NH3⌋Cl + Cu(OH)2 ↓
b, Phản ứng với acid nitro
Amin bậc 1:
Amin bậc một dãy béo tác dụng với axit nitrơ tạo thành ancol tương ứng và giải phóng khí N2
C2H5NH2 + HONO → C2H5OH + N2 + H2O (xúc tác HCl)Amin bậc hai:
Amin bậc hai dãy béo cũng như dãy thơm đều tác dụng với axit nitrơ sinh ra nitrosamin (nitrosoamin) là những chất màu vàng, nhờ đó phân biệt được amin bậc hai với amin bậc một:
(CH3)2NH + HONO → (CH3)2N-N=O + H2OAmin bậc ba
Amin bậc 3 dãy béo không tác dụng với axit nitrơ hoặc chỉ tạo thành muối không bền dễ bị thủy phân
III- Điều chế
- Ankyl hóa amoniac và amin bậc thấp hơn:
Dẫn xuất halogen tác dụng với amoniac và với amin tạo thành một hỗn hợp amin có bậc khác nhau và muối amoni bậc bốn. Nếu trong sơ đồ diều chế dùng dư amoniac, amin bậc một chiếm ưu thế. Điều chế riêng amin bậc một (không lẫn amin bậc cao hơn), người ta ankyl hóa kali phtalimit rồi thủy phân sản phẩm.
IV- Ví dụ
Ví dụ 1:Bậc amin là
A. bậc của nguyên tử C liên kết với chức amin.
B. bậc của nguyên tử N trong chức amin.
C. số gốc hiđrocacbon liên kết với nguyên tử nitơ của amin.
D. số nguyên tử H của NH3 đã bị thay thế bởi gốc hiđrocacbon..
Ví dụ 2: Chất nào sau đây là amin bậc 2 ?
A. H2N-CH2-NH2 . B. (CH3)2CH-NH2. C. CH3-NH-CH3. D. (CH3)3N.
Ví dụ 3: Chất nào sau đây thuộc loại amin bậc 3 ?
A. (CH3)3N. B. CH3-NH2. C. C2H5-NH2. D. CH3-NH-CH3